近岸類器官課堂-“腸來腸往”
Novoprotein 2022-05-20 15:06 發表於浙江
腸上皮是成年哺乳動物自我更新最快的組織,平均自我更新時間少於5天。腸幹細胞位於腸隱窩(intestinal crypt)底部附近,每個隱窩中的幹細胞大約有4-6個,它們產生快速增殖的轉運擴增(TA)細胞,腸細胞、杯狀細胞和腸內分泌細胞都從TA細胞發育而來。TA細胞快速分裂、轉運擴增的子細胞佔據了隱窩的其餘部分,並流向絨毛的側面,在那裡它們分化、吸收營養,最終在絨毛尖端凋亡【1 】。
在體外可以由hPSCs來模擬胚胎腸發育的過程,透過添加高濃度的FGF4和Wnt3A,促使hPSCs衍生的終內胚層(DE)向中腸和後腸內胚層分化,並促進腸管樣形態發生,進而產生包含吸收性腸細胞以及主要分泌譜系(包括Paneth細胞、杯狀細胞和腸內分泌細胞)的腸道類器官。本篇文章基於Nature protocols 【2】整理了hPSCs細胞來源的腸類器官培養方案。
細胞來源
hPSCs
培養基配方
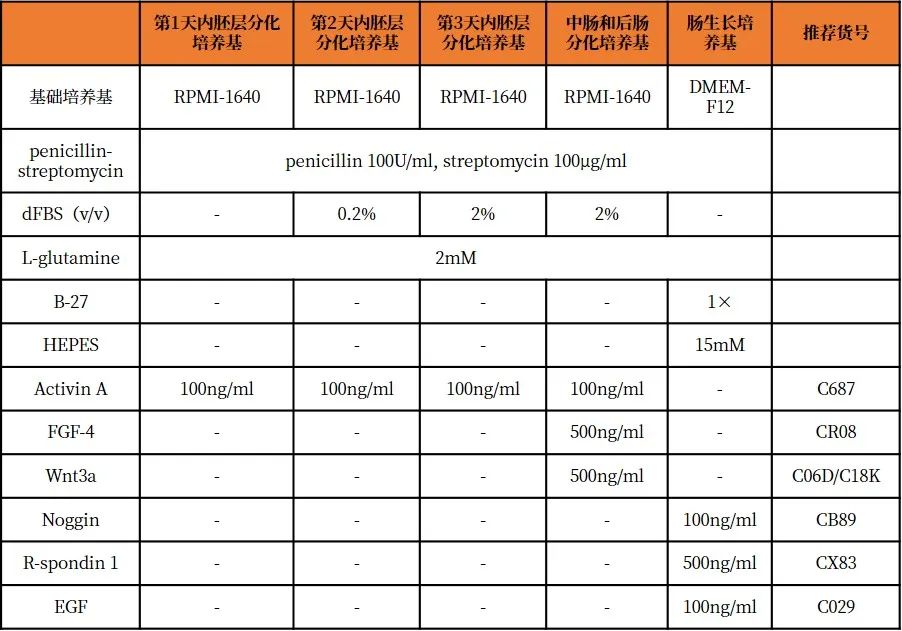
hPSCs培養與繼代
1.將凍存的Matrigel在4°C下過夜解凍,在6孔板的每孔滴加1ml冷的Matrigel,旋動6孔板使Matrigel溶液分佈均勻。接著轉移至37℃條件下培養10min使其凝固,使用前需室溫靜置1h。
2.將hPSCs接種在包被Matrigel的6孔板中,每孔加入3ml mTeSR1,放置在37℃,5%CO 2的培養箱中,培養至細胞融合度約75–85%、且大部分無分化的狀態時,吸出培養基。
3.在hPSCs中加入1 ml Dispase(1mg/ml),並將培養皿放置在37℃條件下進行解離,直到所有的細胞都以小細胞塊或單細胞的形式漂浮。在每個孔中加入5ml的DMEM-F12,以充分稀釋Dispase。
4.將所有細胞轉移至離心管中,室溫下300g離心3min,收集沉澱細胞。加入DMEM-F12培養基,以1:6的比例接種在Matrigel包被的24孔培養板中,向每個孔中加入0.5ml預熱的mTeSR1進行培養,在2-4天內細胞匯合度達到85 -90%。
hPSCs分化成DE
5.吸出mTeSR1,在每個孔中加入0.5 ml預熱的第1天內胚層分化培養基,並將平板放回37℃,5%CO 2的培養箱中。
6.24h後,吸出第1天內胚層分化培養基,換成每孔0.5ml預熱的第2天內胚層分化培養基,並將平板放回37℃,5%CO 2的培養箱中。
7.24h後,吸出第2天內胚層分化培養基,換成每孔0.5ml預熱的第3天內胚層分化培養基,並將平板放回37℃,5%CO 2的培養箱中。
8.24h後,吸出第3天內胚層分化培養基,以不含Activin A的第3天內胚層分化培養基洗滌細胞一次。此時在顯微鏡下觀察細胞,應該存在扁平的DE組織,該組織包含非常少的3D結構。
DE分化為中腸和後腸
9.從24孔板中吸出培養基,每孔滴加0.5 ml預熱的中腸和後腸分化培養基。每24h更換一次新鮮中腸和後腸分化培養基,直至96h 。
10.在立體顯微鏡下,可以看到明顯的3D結構。使用200μl移液管吸頭從每個孔中收集球狀體,並將大約50個球狀體集中到1.5ml微量離心管中。
中腸和後腸球狀體生長成人腸類器官
11.收集球狀體後,將微量離心管垂直放置在管架上10min,此時球體經由重力沉澱到離心管底部。吸出上清,控制總體積約25μl。
12.將冷凍的Matrigel在4℃下過夜解凍,添加B-27補充劑(終濃度1×)、R-spondin1(終濃度500ng/ml),Noggin(終濃度100ng/ml)和EGF(終濃度100ng /ml),用移液管吹打混勻,配製成腸基質膠。
13.將球狀體滴加在預冷的腸基質膠中,並將樣本混勻,總體積將達到75μl(50μl基質膠+ 25μl培養基+球狀體)。
14.將混合物接種在4孔板中,注意需接種在孔的中心,避免接觸側壁。
15.將4孔板放入37℃,5% CO 2的培養箱中孵育10min,使Matrigel固化。
16.在每個孔中緩慢滴加0.5ml腸道生長培養基,確保基質膠被完全覆蓋。
17.每隔4天,或當培養基中的酚紅變黃時,更換腸生長培養基。
腸類器官繼代
18.在第14天左右,透過將腸類器官重新包埋在新鮮的Matrigel中,來實現繼代。
19.在顯微鏡下觀察類器官,吸出孔內的培養基,加入少量DMEM-F12培養基。
20.使用200μl移液管吸頭用力上下吹打Matrigel 3-5次,釋放Matrigel中的類器官。
21.在37℃,5% CO 2的培養箱中培養組織14天,每4天更換一次腸道生長培養基。
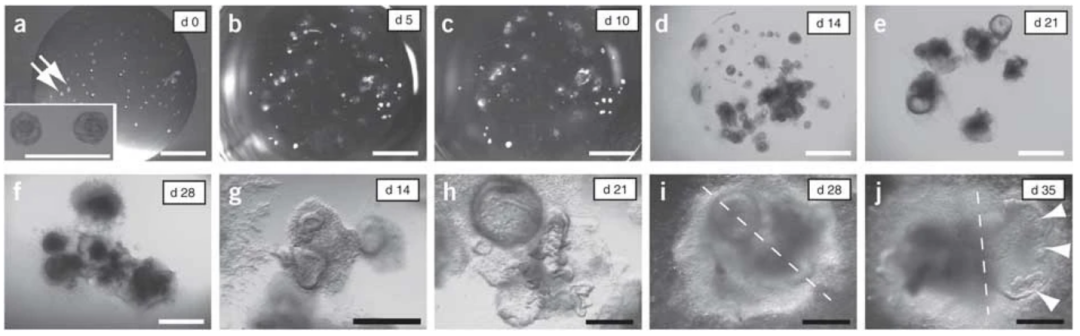
圖1. 人腸類器官的培養過程【2】
腸類器官的最新應用進展
腸道類器官可以在體內移植,作為再生醫學的臨床前工具。2022年2月日本學者Satoshi Watanabe等人【3】利用右旋糖酐硫酸鈉給藥,在結腸遠端引發上皮損傷,隨後將腸道類器官原位移植到受體小鼠的結腸中,實現了上皮細胞的重建。此步驟可在10分鐘內完成,為腸類器官治療潰瘍性結腸炎的臨床試驗奠定了基礎。

圖2. 腸類器官(綠色)在移植1週後,成功整合到小鼠上皮損傷的區域【3】
參考文獻
【1】SATO, Toshiro, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature , 2009, 459.7244: 262-265.
【2】MCCRACKEN, Kyle W., et al. Generating human intestinal tissue from pluripotent stem cells in vitro. Nature protocols , 2011, 6.12: 1920-1928.
【3】WATANABE, Satoshi, et al. Transplantation of intestinal organoids into a mouse model of colitis. Nature Protocols , 2022, 1-25.
| 貨號 | 產品名稱 |
| C076 | Human/Mouse/Rat BDNF |
| C012 | Human/Mouse/Rat BMP-2 |
| C688 | Human DKK1 (N-8His) |
| C079 | Human NT-3 |
| C044 | Mouse FGF basic/FGF-2/bFGF |
| CH73 | Human FGF-7/KGF |
| C198 | Human FGF-9 |
| CR12 | Mouse FGF-9 (N-6His) |
| CR11 | Human FGF-10 |
| C226 | Human GDNF |
| CJ72 | Human HGF (C-6His) |
| CC13 | Mouse HGF (C-6His) |
| C017 | Human LIF |
| C690 | Mouse LIF |
| C753 | Human NRG1-beta 1 |
| C736 | Human Prolactin/PRL |
| CB79 | Human R-spondin 3 (C-Fc-6His) |
| C100 | Human Shh |
| C089 | Human Shh (C24II) |
| CH69 | Mouse Shh |
| CH66 | Mouse Shh(C25II) |
